NÓS FALAMOS CIÊNCIA
Oferecemos aos nossos clientes um conjunto completo de serviços que atendem às necessidades de escrita técnico-científica. Nossos relatórios são fundamentados em referências reconhecidas pela comunidade científica e em medicina baseada em evidências, incluindo livros técnico-científicos, artigos publicados em periódicos indexados pelo sistema WEB QUALIS, bases científicas eletrônicas do Portal Periódicos Capes e documentos oficiais de instituições governamentais brasileiras.Oferecemos suporte regulatório para registro e pós-registro de medicamentos, auxiliando nossos Clientes na definição de estratégias e na elaboração de respostas às exigências, além de proporcionar defesa técnica junto a ANVISA.
A empresa se destacou na monitoria de estudos de biodisponibilidade relativa e bioequivalência, oferecendo um serviço de excelência que assegura total segurança nos processos monitorados.
A Phartrials oferece também os serviços de auditorias, com objetivo de qualificar os fornecedores e de avaliação da eficácia do sistema da qualidade, garantindo o cumprimento de normas e procedimentos, e assegurando a qualidade destes processos.
Nossa abordagem de negócio valoriza a expertise, a formação e a experiência no setor de pesquisas farmacêuticas. Proporcionamos uma ampla variedade de recursos e habilidades para entregar projetos conforme acordado.

NOSSOS SERVIÇOS
MONITORIA DE ESTUDOS CLÍNICOS
A Phartrials realiza monitoria em estudos de Pesquisa Clínica e de Biodisponibilidade relativa/Bioequivalência em centro de pesquisa in loco, em conformidade com a regulamentação de Boas Práticas Clínicas (ICH - GCP), com emissão de relatórios para o Patrocinador e Centros de pesquisa, contemplando ações preventivas e corretivas.
Somos habilitados para atuar de acordo com as normas de Boas Práticas Clínicas (ICH – GCP) e em conformidade com as diretrizes próprias (POPs - Procedimentos Operacionais Padrão) de seu Sistema da Qualidade, assegurando que o estudo clínico é conduzido, registrado e relatado em total conformidade com o protocolo clínico.
A monitoria de estudo clínico tem o objetivo de representar o patrocinador em todas as etapas de condução de um estudo clínico nos processos realizados pelo Centro de Pesquisa, do pré-estudo ao pós-estudo.
Além de uma equipe técnica altamente qualificada para realizar o serviço de monitoria, a Phartrials possui como diferencial um sistema informatizado personalizado, utilizado pela equipe via tablet, que permite acompanhamento em tempo real das atividades monitoradas ao decorrer das etapas de um estudo clínico. Diferencial este que assegura que os serviços de monitoria sejam íntegros e seguros, além da otimização dos processos de monitoria.
A Phartrials iniciou com este serviço em 2020 e já realizou mais de 100 monitorias em Centros de Pesquisas, com total satisfação dos Clientes.
Somos habilitados para atuar de acordo com as normas de Boas Práticas Clínicas (ICH – GCP) e em conformidade com as diretrizes próprias (POPs - Procedimentos Operacionais Padrão) de seu Sistema da Qualidade, assegurando que o estudo clínico é conduzido, registrado e relatado em total conformidade com o protocolo clínico.
A monitoria de estudo clínico tem o objetivo de representar o patrocinador em todas as etapas de condução de um estudo clínico nos processos realizados pelo Centro de Pesquisa, do pré-estudo ao pós-estudo.
Além de uma equipe técnica altamente qualificada para realizar o serviço de monitoria, a Phartrials possui como diferencial um sistema informatizado personalizado, utilizado pela equipe via tablet, que permite acompanhamento em tempo real das atividades monitoradas ao decorrer das etapas de um estudo clínico. Diferencial este que assegura que os serviços de monitoria sejam íntegros e seguros, além da otimização dos processos de monitoria.
A Phartrials iniciou com este serviço em 2020 e já realizou mais de 100 monitorias em Centros de Pesquisas, com total satisfação dos Clientes.
NOSSOS SERVIÇOS
MONITORIA DE ESTUDOS CLÍNICOS
A Phartrials realiza monitoria em estudos de Pesquisa Clínica e de Biodisponibilidade relativa/Bioequivalência em centro de pesquisa in loco, em conformidade com a regulamentação de Boas Práticas Clínicas (ICH - GCP), com emissão de relatórios para o Patrocinador e Centros de pesquisa, contemplando ações preventivas e corretivas.
Somos habilitados para atuar de acordo com as normas de Boas Práticas Clínicas (ICH – GCP) e em conformidade com as diretrizes próprias (POPs - Procedimentos Operacionais Padrão) de seu Sistema da Qualidade, assegurando que o estudo clínico é conduzido, registrado e relatado em total conformidade com o protocolo clínico.
A monitoria de estudo clínico tem o objetivo de representar o patrocinador em todas as etapas de condução de um estudo clínico nos processos realizados pelo Centro de Pesquisa, do pré-estudo ao pós-estudo.
Além de uma equipe técnica altamente qualificada para realizar o serviço de monitoria, a Phartrials possui como diferencial um sistema informatizado personalizado, utilizado pela equipe via tablet, que permite acompanhamento em tempo real das atividades monitoradas ao decorrer das etapas de um estudo clínico. Diferencial este que assegura que os serviços de monitoria sejam íntegros e seguros, além da otimização dos processos de monitoria.
A Phartrials iniciou com este serviço em 2020 e já realizou mais de 100 monitorias em Centros de Pesquisas, com total satisfação dos Clientes.
Somos habilitados para atuar de acordo com as normas de Boas Práticas Clínicas (ICH – GCP) e em conformidade com as diretrizes próprias (POPs - Procedimentos Operacionais Padrão) de seu Sistema da Qualidade, assegurando que o estudo clínico é conduzido, registrado e relatado em total conformidade com o protocolo clínico.
A monitoria de estudo clínico tem o objetivo de representar o patrocinador em todas as etapas de condução de um estudo clínico nos processos realizados pelo Centro de Pesquisa, do pré-estudo ao pós-estudo.
Além de uma equipe técnica altamente qualificada para realizar o serviço de monitoria, a Phartrials possui como diferencial um sistema informatizado personalizado, utilizado pela equipe via tablet, que permite acompanhamento em tempo real das atividades monitoradas ao decorrer das etapas de um estudo clínico. Diferencial este que assegura que os serviços de monitoria sejam íntegros e seguros, além da otimização dos processos de monitoria.
A Phartrials iniciou com este serviço em 2020 e já realizou mais de 100 monitorias em Centros de Pesquisas, com total satisfação dos Clientes.
ELABORAÇÃO DE DOCUMENTAÇÃO TÉCNICO-CIENTÍFICA E/OU AVALIAÇÃO PARA ADEQUAÇÃO ÀS NORMAS REGULATÓRIAS
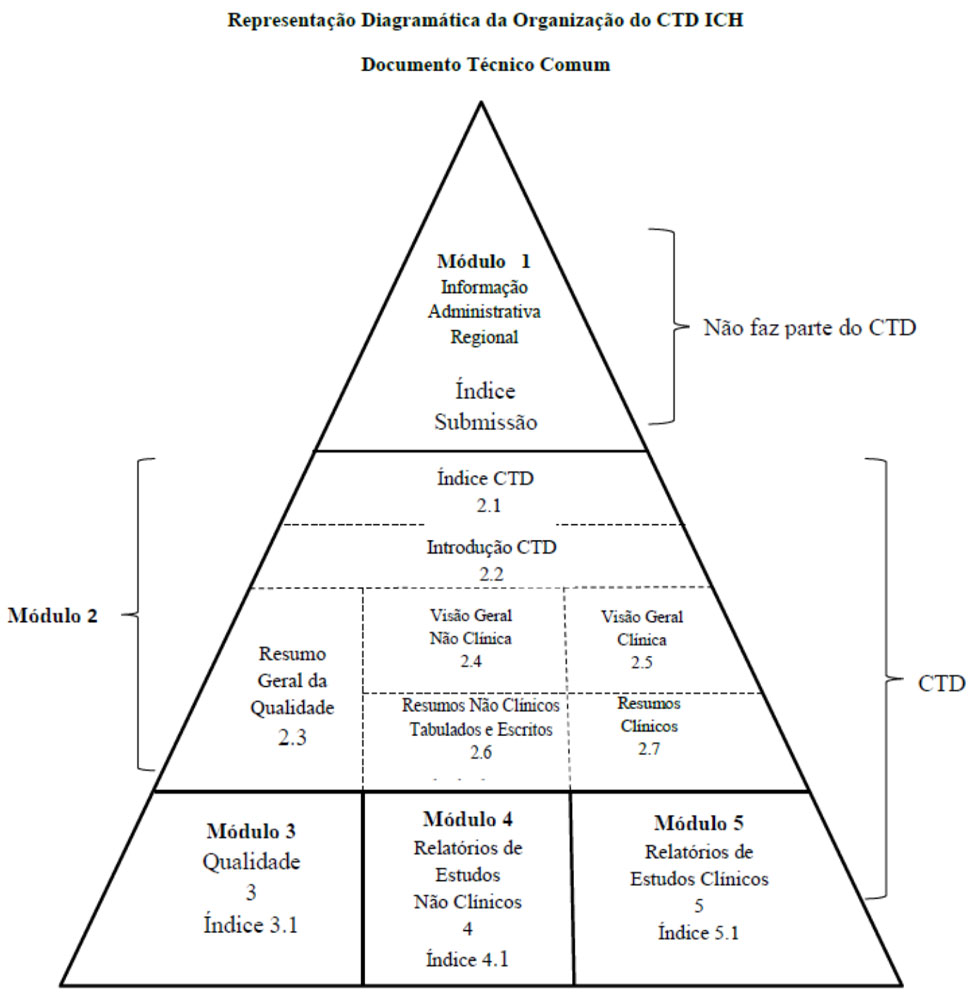
Documentação Técnica no formato CTD (conforme Guia 24/2019), formato comum para a preparação de um pedido de registro e pós-registro de medicamento bem estruturado a ser submetido à ANVISA:
- Informação Administrativa (módulo 1) – Específico da ANVISA;
- Índice CTD (2.1);
- Introdução CTD (2.2.);
- Módulos Não Clínicos (2.4, 2.6 e 4):
Levantamento Bibliográfico para composição da Documentação Técnica
Visão Geral Não Clínica
Resumos Não Clínicos Tabulados e Escritos (Farmacologia, Farmacocinética e Toxicologia)
Relatórios de Estudos Não Clínicos
- Módulos Clínicos (2.5, 2.7 e 5):
Revisão Sistemática da Literatura dos Estudos Clínicos
Visão Geral Clínica
Resumos Clínicos (Estudos Biofarmacêuticos, Métodos Analíticos, Farmacologia Clínica, Eficácia e Segurança)
Relatórios de Estudos Clínicos
- Informação Administrativa (módulo 1) – Específico da ANVISA;
- Índice CTD (2.1);
- Introdução CTD (2.2.);
- Módulos Não Clínicos (2.4, 2.6 e 4):
Levantamento Bibliográfico para composição da Documentação Técnica
Visão Geral Não Clínica
Resumos Não Clínicos Tabulados e Escritos (Farmacologia, Farmacocinética e Toxicologia)
Relatórios de Estudos Não Clínicos
- Módulos Clínicos (2.5, 2.7 e 5):
Revisão Sistemática da Literatura dos Estudos Clínicos
Visão Geral Clínica
Resumos Clínicos (Estudos Biofarmacêuticos, Métodos Analíticos, Farmacologia Clínica, Eficácia e Segurança)
Relatórios de Estudos Clínicos
Dossiê de Desenvolvimento Clínico de Medicamentos (DDCM), compilado de documentos a ser submetido à ANVISA com a finalidade de se avaliar as etapas inerentes ao desenvolvimento de um medicamento experimental visando à obtenção de informações para subsidiar o registro ou alterações pós-registro do referido produto.
Brochura do Investigador, documento que contém a compilação dos dados não clínicos e clínicos de um medicamento experimental que são relevantes para o estudo em seres humanos, com objetivo de fornecer aos investigadores e a outros envolvidos na condução do ensaio clínico informações relativas à dose, regime posológico, métodos de administração e procedimentos de monitoramento de segurança.
Protocolos de estudo de Bioequivalência Farmacêutica, documento que descreve os objetivos, desenho, metodologia, considerações estatísticas e organização do ensaio. Provê também o contexto e a fundamentação do ensaio clínico.
Estudos de biodisponibilidade relativa/bioequivalência, avaliação dos dados e informações (relatórios) da parte clínica, bioanalítico e estatística, para identificar necessidades de adequação regulatória.
Relatórios Técnico-Científicos:
- Eficácia e segurança – medicamentos específicos;
- Farmacocinética linear para bioisenção.
Confecção de bulas, com informações sobre a prescrição, preparação, administração, advertência e outras orientações para o uso seguro e tratamento eficaz.
Brochura do Investigador, documento que contém a compilação dos dados não clínicos e clínicos de um medicamento experimental que são relevantes para o estudo em seres humanos, com objetivo de fornecer aos investigadores e a outros envolvidos na condução do ensaio clínico informações relativas à dose, regime posológico, métodos de administração e procedimentos de monitoramento de segurança.
Protocolos de estudo de Bioequivalência Farmacêutica, documento que descreve os objetivos, desenho, metodologia, considerações estatísticas e organização do ensaio. Provê também o contexto e a fundamentação do ensaio clínico.
Estudos de biodisponibilidade relativa/bioequivalência, avaliação dos dados e informações (relatórios) da parte clínica, bioanalítico e estatística, para identificar necessidades de adequação regulatória.
Relatórios Técnico-Científicos:
- Eficácia e segurança – medicamentos específicos;
- Farmacocinética linear para bioisenção.
Confecção de bulas, com informações sobre a prescrição, preparação, administração, advertência e outras orientações para o uso seguro e tratamento eficaz.
ELABORAÇÃO DE DOCUMENTAÇÃO TÉCNICO-CIENTÍFICA E/OU AVALIAÇÃO PARA ADEQUAÇÃO ÀS NORMAS REGULATÓRIAS
Documentação Técnica no formato CTD (conforme Guia 24/2019), formato comum para a preparação de um pedido de registro e pós-registro de medicamento bem estruturado a ser submetido à ANVISA:
- Informação Administrativa (módulo 1) – Específico da ANVISA;
- Índice CTD (2.1);
- Introdução CTD (2.2.);
- Módulos Não Clínicos (2.4, 2.6 e 4):
Levantamento Bibliográfico para composição da Documentação Técnica
Visão Geral Não Clínica
Resumos Não Clínicos Tabulados e Escritos (Farmacologia, Farmacocinética e Toxicologia)
Relatórios de Estudos Não Clínicos
- Módulos Clínicos (2.5, 2.7 e 5):
Revisão Sistemática da Literatura dos Estudos Clínicos
Visão Geral Clínica
Resumos Clínicos (Estudos Biofarmacêuticos, Métodos Analíticos, Farmacologia Clínica, Eficácia e Segurança)
Relatórios de Estudos Clínicos
- Informação Administrativa (módulo 1) – Específico da ANVISA;
- Índice CTD (2.1);
- Introdução CTD (2.2.);
- Módulos Não Clínicos (2.4, 2.6 e 4):
Levantamento Bibliográfico para composição da Documentação Técnica
Visão Geral Não Clínica
Resumos Não Clínicos Tabulados e Escritos (Farmacologia, Farmacocinética e Toxicologia)
Relatórios de Estudos Não Clínicos
- Módulos Clínicos (2.5, 2.7 e 5):
Revisão Sistemática da Literatura dos Estudos Clínicos
Visão Geral Clínica
Resumos Clínicos (Estudos Biofarmacêuticos, Métodos Analíticos, Farmacologia Clínica, Eficácia e Segurança)
Relatórios de Estudos Clínicos
Dossiê de Desenvolvimento Clínico de Medicamentos (DDCM), compilado de documentos a ser submetido à ANVISA com a finalidade de se avaliar as etapas inerentes ao desenvolvimento de um medicamento experimental visando à obtenção de informações para subsidiar o registro ou alterações pós-registro do referido produto.
Brochura do Investigador, documento que contém a compilação dos dados não clínicos e clínicos de um medicamento experimental que são relevantes para o estudo em seres humanos, com objetivo de fornecer aos investigadores e a outros envolvidos na condução do ensaio clínico informações relativas à dose, regime posológico, métodos de administração e procedimentos de monitoramento de segurança.
Protocolos de estudo de Bioequivalência Farmacêutica, documento que descreve os objetivos, desenho, metodologia, considerações estatísticas e organização do ensaio. Provê também o contexto e a fundamentação do ensaio clínico.
Estudos de biodisponibilidade relativa/bioequivalência, avaliação dos dados e informações (relatórios) da parte clínica, bioanalítico e estatística, para identificar necessidades de adequação regulatória.
Relatórios Técnico-Científicos:
- Eficácia e segurança – medicamentos específicos;
- Farmacocinética linear para bioisenção.
Confecção de bulas, com informações sobre a prescrição, preparação, administração, advertência e outras orientações para o uso seguro e tratamento eficaz.
Brochura do Investigador, documento que contém a compilação dos dados não clínicos e clínicos de um medicamento experimental que são relevantes para o estudo em seres humanos, com objetivo de fornecer aos investigadores e a outros envolvidos na condução do ensaio clínico informações relativas à dose, regime posológico, métodos de administração e procedimentos de monitoramento de segurança.
Protocolos de estudo de Bioequivalência Farmacêutica, documento que descreve os objetivos, desenho, metodologia, considerações estatísticas e organização do ensaio. Provê também o contexto e a fundamentação do ensaio clínico.
Estudos de biodisponibilidade relativa/bioequivalência, avaliação dos dados e informações (relatórios) da parte clínica, bioanalítico e estatística, para identificar necessidades de adequação regulatória.
Relatórios Técnico-Científicos:
- Eficácia e segurança – medicamentos específicos;
- Farmacocinética linear para bioisenção.
Confecção de bulas, com informações sobre a prescrição, preparação, administração, advertência e outras orientações para o uso seguro e tratamento eficaz.
AUDITORIA PARA QUALIFICAÇÃO DE CENTRO DE BIOEQUIVALÊNCIA FARMACÊUTICA
Garantir através da auditoria junto ao Centro de pesquisa a conformidade dos processos e das Boas Práticas Clínicas para a realização dos estudos de Bioequivalência Farmacêutica para qualificá-lo como fornecedor.
AUDITORIA PARA QUALIFICAÇÃO DE CENTRO DE BIOEQUIVALÊNCIA FARMACÊUTICA
Garantir através da auditoria junto ao Centro de pesquisa a conformidade dos processos e das Boas Práticas Clínicas para a realização dos estudos de Bioequivalência Farmacêutica para qualificá-lo como fornecedor.
AUDITORIA PARA QUALIFICAÇÃO DE CENTRO DE EQUIVALÊNCIA FARMACÊUTICA (EQFAR)
Garantir através da auditoria junto ao Centro de pesquisa a conformidade dos processos e das Boas Práticas Clínicas para a realização dos estudos de Bioequivalência Farmacêutica para qualificá-lo como fornecedor.
AUDITORIA PARA QUALIFICAÇÃO DE CENTRO DE EQUIVALÊNCIA FARMACÊUTICA (EQFAR)
Garantir através da auditoria junto ao Centro de pesquisa a conformidade dos processos e das Boas Práticas Clínicas para a realização dos estudos de Bioequivalência Farmacêutica para qualificá-lo como fornecedor.
AUDITORIA NO SISTEMA DE GESTÃO DA QUALIDADE
Processo para determinar a eficácia e a eficiência do sistema de qualidade implementado na empresa de acordo com os objetivos de qualidade especificados, a auditoria do SGQ é uma ferramenta indispensável. A auditoria avalia o estado de adequação e conformidade do sistema em relação às normas, políticas, objetivos estratégicos e procedimentos definidos e aplicados pelo Cliente.
AUDITORIA NO SISTEMA DE GESTÃO DA QUALIDADE
Processo para determinar a eficácia e a eficiência do sistema de qualidade implementado na empresa de acordo com os objetivos de qualidade especificados, a auditoria do SGQ é uma ferramenta indispensável. A auditoria avalia o estado de adequação e conformidade do sistema em relação às normas, políticas, objetivos estratégicos e procedimentos definidos e aplicados pelo Cliente.

Avenida Anhanguera, qd. 38 lt. 96, Nº 4803, Sala 1404, Ed. Rita de Albuquerque, Setor Central, Goiânia-GO, CEP: 740430-11
EMPRESA - QUEM SOMOS?
POLÍTICA DA QUALIDADE
MISSÃO
VISÃO
VALORES
POLÍTICA DE RESPONSABILIDADE SOCIOAMBIENTAL
EQUIPE
POLÍTICA DA QUALIDADE
MISSÃO
VISÃO
VALORES
POLÍTICA DE RESPONSABILIDADE SOCIOAMBIENTAL
EQUIPE
NOSSOS SERVIÇOS
NÓS FALAMOS CIÊNCIA!
MONITORIA EM ESTUDOS CLÍNICOS
ELABORAÇÃO DE DOCUMENTAÇÃO TÉCNICO-CIENTÍFICA E/OU AVALIAÇÃO PARA ADEQUAR ÀS NORMAS REGULATÓRIAS
AUDITORIA PARA QUALIFICAÇÃO DE CENTRO DE BIOEQUIVALÊNCIA FARMACÊUTICA
NÓS FALAMOS CIÊNCIA!
MONITORIA EM ESTUDOS CLÍNICOS
ELABORAÇÃO DE DOCUMENTAÇÃO TÉCNICO-CIENTÍFICA E/OU AVALIAÇÃO PARA ADEQUAR ÀS NORMAS REGULATÓRIAS
AUDITORIA PARA QUALIFICAÇÃO DE CENTRO DE BIOEQUIVALÊNCIA FARMACÊUTICA
AUDITORIA PARA QUALIFICAÇÃO DE CENTRO DE EQUIVALÊNCIA FARMACÊUTICA (EQFAR)
AUDITORIA NO SISTEMA DE GESTÃO DA QUALIDADE
NOTÍCIAS E POSTAGENS
CONTATO
AUDITORIA NO SISTEMA DE GESTÃO DA QUALIDADE
NOTÍCIAS E POSTAGENS
CONTATO



