- Filtrar por
- Categorias
- Tags
- Autores
- Todos
- artigo científico
- comunicação médico-cientícica
- conteúdos ténicos-científicos
- desenvolvimento clínico de medicamentos
- desenvolvimento de medicamentos
- dossiê de desenvolvimento clínico de medicamentos
- elaboração de conteúdos técnicos-científicos
- estudo de bioequivalência
- patentes de medicamentos
- projetos de pesquisa
- protocolos de estudo de bioequivalência
- protocolos de pesquisa clinica
- redação científica
- redação de patentes de medicamentos
29/04/2022
A resolução publicada no DOU em 30 de março de 2022 entrará em vigência no dia 02 de maio de 2022 dispondo sobre as diretrizes gerais […]
Você gosta disso?0
14/04/2022
Os critérios para Certificação de Boas Práticas de Fabricação (CBPF) para estabelecimentos internacionais fabricantes de Insumos Farmacêuticos Ativos (IFAs) obtidos por extração vegetal, síntese química, fermentação […]
Você gosta disso?0
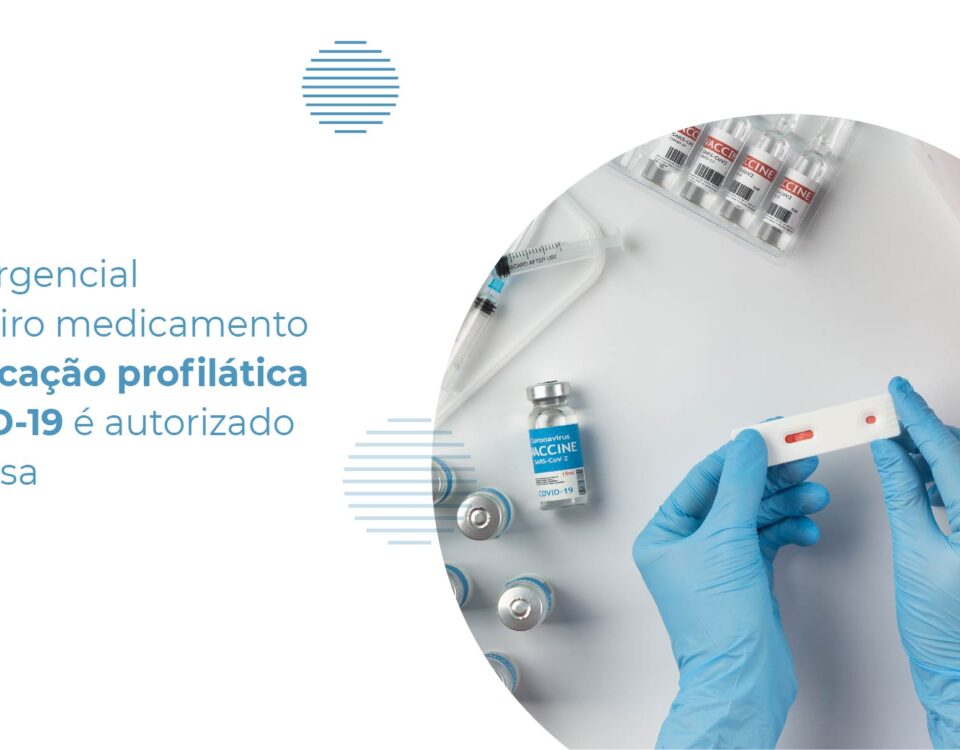
01/04/2022
No dia 28/03, o uso emergencial dos medicamentos REGN-COV2 (carisivimabe e imdesivimabe) e Regkirona (regdanvimabe), empregados para o tratamento de casos leves e moderados de Covid-19 […]
Você gosta disso?0
25/03/2022
As Boas Práticas em Células Humanas para Uso Terapêutico e em pesquisa clínica compreendem os requisitos técnico-sanitários mínimos relacionados ao ciclo produtivo de células e Produtos […]
Você gosta disso?0
18/03/2022
A RDC nº 601, de 9 de fevereiro de 2022, que dispõe sobre a análise simplificada, em caráter excepcional e temporário, no âmbito da Coordenação de Pesquisa […]
Você gosta disso?0
11/03/2022
O Evusheld® (cilgavimabe + tixagevimabe), da empresa AstraZeneza, obteve sua autorização temporária de uso emergencial, em caráter experimental, em 24/02/2022 pela Anvisa. Tixagevimabe e Cilgavimabe são anticorpos monoclonais […]
Você gosta disso?0
04/03/2022
No dia 23/02/2022, a Anvisa aprovou o primeiro registro sanitário no Brasil para o produto de terapia avançada para câncer hematológico Kymriah® (tisagenlecleucel), da empresa Novartis Biociências S.A. Por se tratar […]
Você gosta disso?0
18/02/2022
O sistema de liberação que oferece a garantia de que determinado produto esterilizado terminalmente possui a qualidade pretendida, com base em informações acumuladas durante o processo […]
Você gosta disso?0
11/02/2022
A Farmacovigilância é definida como ciência e atividades relativas à detecção, avaliação, compreensão e prevenção de Eventos Adversos ou quaisquer outros problemas relacionados a medicamentos. De […]
Você gosta disso?0
04/02/2022
Os critérios para a validação de métodos analíticos são estabelecidos pela RDC nº 166, de 24 de julho de 2017. Para métodos quantitativos e ensaios limite, a […]
Você gosta disso?0
28/01/2022
14/01/2022
A RDC nº 317, de 22 de outubro de 2019 estabelece o prazo de 10 (dez) anos para a validade do registro de medicamentos. Para os medicamentos […]
Você gosta disso?0